Il filosofo romano Plinio, (23 —79 d.C.), ha scritto spesso di Ferrum corrumpitur (il ferro è destinato a corrompersi), in quanto l’impero romano, la civiltà allora più importante del mondo, faceva un largo uso di ferro in armi e altri manufatti.
Plinio si chiese: perché il ferro si corrode più facilmente di altri metalli?
Diede una risposta metafisica (cos’altro avrebbe potuto fare, all’epoca non esisteva la scienza sperimentale):
Il ferro è sia il migliore che il peggiore dei servi dell’uomo, anche se molto utile, è anche il metallo della guerra.
Plinio quindi considerava la ruggine una punizione degli dei, poiché il ferro si lascia utilizzare per le spade e le altre armi.
Una conseguenza della sua filosofia era il convincimento che la corrosione potesse essere evitata con cerimonie religiose. Ma le catene di un ponte sospeso, costruito per Alessandro Magno e inaugurato con una cerimonia religiosa, si corrosero ugualmente.
I Romani però erano gente molto pratica e senza porsi il problema del perché il ferro si arrugginisce, misero a punto delle tecniche per proteggerlo e ridurne la corrosione. Dice infatti ancora Plinio:
Si preserva dalla ruggine con biacca, gesso e pece liquida. Questa è chiamata dai Greci ’naturale avversione’ (antipathia) al ferro.
Dopo Plinio solo nel 1600 le cronache registrano un nuovo episodio di corrosione.
Nel 1681 Samuel Pepys, segretario dell’Ammiragliato britannico, decise la rimozione delle guaine di piombo messe a protezione degli scafi della Marina, in quanto si era osservata una forte corrosione dei perni in ferro del timone. Pepys confessò di non conoscere la cause di questa corrosione.
Oggi conosciamo bene i meccanismi della corrosione bimetallica, ma Pepys non poteva sapere nulla di tutto ciò, semplicemente perché allora non esistevano i concetti di corrente elettrica, di differenza di potenziale, di elettroni, di fenomeni elettrochimici, anzi persino di elettricità, tutti scoperti più tardi.
Galvani e Volta
Alessandro Volta (1745-1827) iniziò a fare degli esperimenti per confermare la teoria di Galvani che l’elettricità era di origine animale. Tuttavia, ben presto verificò che essa era dovuta alla presenza dei due puntali di metalli diversi usati nell’esperimento.
Volta disse: è la diversità dei metalli, che fa.
Dopo aver capito che era la diversità dei metalli a produrre corrente, Volta costruì la sua storica pila con dischi di rame e zinco alternati con interposti feltri imbevuti di acqua e acido solforico. Con questa mise a disposizione del mondo accademico uno strumento formidabile per la ricerca: la pila di Volta era piccola, facilmente costruibile, maneggevole e in grado di produrre correnti costanti e di lunga durata.
È la differenza di potenziale tra i due metalli che dà origine al fluido elettrico, come chiamava Volta la corrente elettrica.
Ma cosa c’entra la pila di Volta con la corrosione?
Volta notò che lo zinco si corrodeva ma credette si trattasse di un difetto delle sue pile.

Oggi sappiamo che non era un difetto, ma che accoppiando due metalli diversi quello con un potenziale intrinseco inferiore si corrode.

Oggi siamo in grado di misurare con accuratezza il potenziale Volta di tutti i metalli. Immergendo in un liquido conduttore, detto elettrolita (per esempio acqua salata) due metalli diversi si può misurare la differenza di potenziale tra i due metalli. Ma non è facile misurarla direttamente a causa delle basse tensioni in gioco, bisogna farlo rispetto un metallo di riferimento, in genere con acqua di mare come elettrolita si usa Argento/Cloruro di Argento.
Nella pila di Volta tra il disco di zinco e quello di rame, la differenza di potenziale è di circa 0,68 volt, un buon valore, sicuramente sufficiente a far scorrere corrente tra i due metalli. La differenza di potenziale, infatti, deve essere superiore a circa 0,2 volt affinché la pila si attivi.
È possibile fare un elenco dei metalli da quelli con maggior potenziale, detti nobili, via via a scendere di potenziale, formando una serie detta galvanica, come quella semplificata riportata in Figura 2.
La corrosione dello zinco è intrinseca al funzionamento della pila ed è appunto la corrosione galvanica di cui stiamo parlando. Il metallo a potenziale inferiore, detto anodo, si corrode sempre.
La pila ha bisogno di quattro elementi: due metalli diversi, un elettrolita e un contatto elettrico tra i due metalli.
Questo è un principio fondamentale: si forma sempre una cella voltaica, e di conseguenza la corrosione, quando esistono tutti e quattro gli elementi suddetti. Vale anche la regola inversa: se manca anche uno solo di questi elementi non si forma la cella galvanica, non scorre corrente e non si forma corrosione. Infatti nei climi secchi, dove non c’è acqua e quindi non c’è l’elettrolita, non si nota corrosione. Se i due metalli non sono in contatto tra loro, non c’è corrosione, per cui una ovvia difesa è l’isolamento. Se i due metalli non sono diversi, non si forma corrosione galvanica. L’acqua dolce, possedendo pochissimi sali, non è un buon elettrolita, per questo motivo le barche nei laghi si corrodono meno. Va notato che alla lunga l’anodo si consuma completamente, mentre il catodo resta intatto.
Michael Faraday è stato un altro importante scienziato che ha dato un forte impulso alla conoscenza della corrosione. È il padre della elettrolisi, di cui scoprì le leggi, ma la sua scoperta fondamentale fu l’induzione elettromagnetica (1831) che permise di ottenere elettricità non più da pile ma da appositi generatori che trasformano la potenza meccanica in elettricità, le dinamo.
Sono suoi i termini ancor oggi in uso di elettrodo, elettrolisi, catodo, anodo e ione.
Albert Einstein teneva una foto di Faraday nel suo studio assieme a quelle di Isaac Newton e James Clerk Maxwell.
Nonostante i meccanismi della corrosione fossero oramai abbastanza chiari, la pratica faticava a comprenderli, come dimostrano le barche progettate da Herreshoff.
Il grande progettista utilizzò con disinvoltura metalli diversi per le sue barche.
Nel 1895 progettò e costruì lo yacht Defender di 37,5 metri con lo scafo in bronzo-alluminio e l’opera viva in nichel-alluminio.

Defender vinse la Coppa America nel 1895 ma subito dopo iniziò a dissolversi e venne demolita nel 1901.
La corrosione iniziava ad essere capita, ma solo nel 1891 Nernst pubblicherà la sua fondamentale equazione che regola la teoria delle celle galvaniche. Nel 1897 J.J. Thomson scoprirà gli elettroni e infine nel 1924 si avrà la completa teoria della corrosione, elaborata da Ulrick Evans nel suo fondamentale testo La corrosione dei metalli.
La cella galvanica può prodursi anche in una lega tra due metalli. Il caso più noto è quello dell’ottone, che è una lega di rame e zinco. Una volta che l’ottone è immerso in acqua o semplicemente è ricoperto da un velo di umidità, le molecole superficiali di zinco diventano degli anodi e quelle di rame dei catodi, esattamente come nella pila di Volta. Lo zinco si consuma, l’ottone assume un colore rosso e diventa una spugna di rame. Per questo l’ottone non deve essere mai usato né per le eliche né per le attrezzature di coperta, salvo quelle usate all’interno dell’imbarcazione.
La corrosione di un solo metallo
La corrosione dei metalli non avviene unicamente tra due metalli diversi ma anche in un solo metallo se bagnato.
In natura, se escludiamo l’oro e pochissimi altri metalli, non si trovano metalli puri ma solo i loro ossidi. L’ossido è la forma preferita dei metalli alla quale inesorabilmente tendono.
Talvolta l’ossido resta saldamente ancorato al metallo e lo protegge da ulteriori corrosioni, come avviene nell’alluminio, dove si forma l’allumina, un ossido particolarmente resistente, e negli acciai inossidabili (che in realtà si dovrebbero chiamare iperossidabili). Altre volte l’ossido si distacca lasciando libera la superficie sottostante che riprende a corrodersi, come avviene nel ferro con la ruggine, portando alla totale distruzione del metallo.
Anche in questo caso però si tratta di un fenomeno corrosivo di tipo galvanico, dove delle celle composte da microanodi e microcatodi si formano sulla superficie dello stesso metallo bagnato. Queste celle si spostano continuamente sulla superficie del metallo cosicché la corrosione diventa uniforme.
Nel caso in cui le microcelle non si muovano, per esempio quando sono dovute a impurità nel metallo oppure a zone con differente aerazione, la corrosione si concentra nello stesso punto e forma quella che si chiama corrosione a cratere, più conosciuta con il nome anglosassone di crevice.

Nella Figura 5 si vede un asse di timone che sembra tagliato in corrispondenza del cuscinetto. Questo era del tipo chiuso e non permetteva l’ingresso dell’acqua se non in piccolissime dosi, quindi sotto il cuscinetto si è formato un ambiente anodico per la scarsità di ricambio dell’acqua e conseguente scarsa ossigenazione, mentre all’esterno la buona ossidazione ha creato un ambiente catodico. L’asse nella zona anodica si è corroso vistosamente.
La corrosione nelle barche
I danni prodotti dalla corrosione sono notevoli anche se spesso sottovalutati.
Probabilmente la diffusione della plastica nella costruzione delle imbarcazioni ha prodotto la falsa sicurezza che queste non siano soggette a corrosione. Non è vero: lo scafo in vetroresina non si corrode ma i bulloni che reggono la chiglia sì.

Se si forma una fessura tra chiglia e scafo nella quale possa passare dell’acqua, questa potrebbe formare una cella galvanica e corrodere il bullone.
Una falsa certezza spinge molti armatori a privilegiare l’acciaio inox a quello zincato o ad altri metalli, ma è una imprudenza. Nonostante il nome, l’acciaio inox si corrode e lo fa in un modo subdolo, da un piccolo forellino in superficie si può dipartire una cavità devastante.

Nella Figura 7 si può vedere un bullone che tratteneva uno strallo, apparentemente sano in superficie ma quasi totalmente corroso all’interno.
In Italia gli scafi metallici, contrariamente a quanto avviene nei mari del Nord, non sono diffusi, vittime di un radicato pregiudizio: gli scafi metallici si corrodono e la barca affonda. Il pregiudizio vale soprattutto per quelle in ferro che effettivamente, se non protette da apposite vernici, si arrugginiscono. Le conseguenze sono meno evidenti in quelle di alluminio, che si autoproteggono grazie alla formazione dell’allumina che non richiede nemmeno la verniciatura.
Oggi esistono cicli di verniciatura protettiva dell’acciaio che garantiscono anni di vita allo scafo, molti di più della vetroresina, che non arrugginisce ma che col tempo si plasticizza, perde di rigidità e rende la barca troppo cedevole. Un primo segno della plasticizzazione è di solito la difficoltà a chiudere le porte delle cabine per la deformazione subita dallo scafo.
Il settore delle imbarcazioni di lusso oggi si indirizza al carbonio, che più precisamente è una resina impregnata con fibre di carbonio. Il risultato è uno scafo (o un albero, un boma) particolarmente resistente e quasi indistruttibile, non si ossida e non si deforma. Purtroppo molti cantieri e armatori ignorano che la fibra di carbonio, pur non essendo un metallo, è un ottimo conduttore di elettricità e che il suo potenziale galvanico è altissimo.
Di conseguenza, il progettista deve disegnare la barca come se fosse metallica e evitare ogni contatto tra il carbonio e altri metalli che si corroderebbero subito. Una chiglia collegata a uno scafo in carbonio con bulloni metallici durerebbe ben poco, questi si corroderebbero velocemente e la perdita della chiglia sarebbe inevitabile. Tutti gli accessori metallici vanno montati isolati dal carbonio, anche le viti di fissaggio.
Ma anche gli scafi in legno conoscono problemi derivanti dalla corrosione.
Una particolarità della cella galvanica è di produrre un ambiente basico nella zona adiacente al catodo. Quando tra due particolari metalli fissati allo scafo, grazie all’umidità contenuta nel legno, si innesca una cella, attorno al metallo che funge da catodo si forma un ambiente basico che corrode il legno.
Ecco che così si vedono spesso le viti dello scafo perdere aderenza e sfilarsi oppure passascafi metallici circondati da legno che sta marcendo con il pericolo di perderli.
Le correnti vaganti
Negli ultimi decenni si assiste a un fenomeno nuovo per le imbarcazioni da diporto: la corrosione per correnti vaganti.
Queste sono delle correnti elettriche che, anziché rientrare ordinatamente alla loro sorgente di elettricità attraverso cavi elettrici, percorrono strade diverse e spesso imprevedibili.
Nel loro percorso illegale possono attraversare dei metalli, corrodendoli; la corrosione causata da queste correnti è veloce e devastante.
La corrosione avviene nel punto in cui la corrente esce dal metallo per entrare nel mare (o nel terreno).
L’origine delle correnti vaganti è molto spesso un impianto elettrico fatto male, ma possono essere causate da una barca vicina o dal marina stessa.
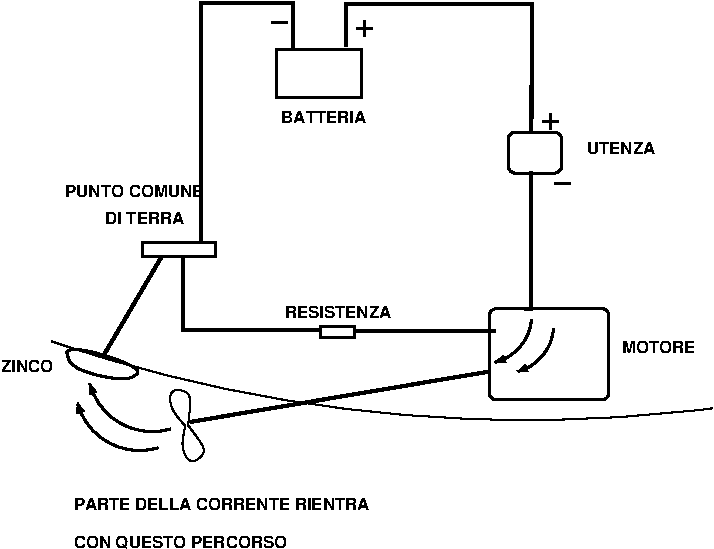
Nella Figura 8 si può notare un classico caso di elica corrosa da correnti vaganti. Il motore è collegato al negativo, come è giusto che sia, ma nel percorso di ritorno “legale” c’è una certa resistenza per cui una parte della corrente transita nel percorso alternativo, elica-mare-scafo-negativo, e uscendo dall’elica la distrugge.
Purtroppo anche se la vostra barca non ha problemi elettrici le correnti vaganti possono arrivare da un’altra barca.
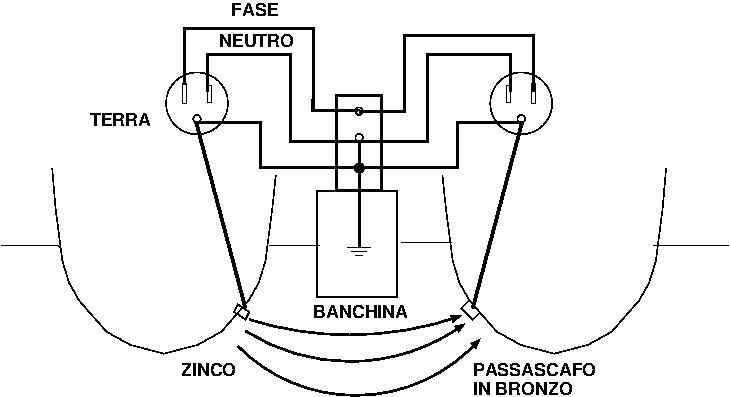
Quando entrambe le barche sono collegate in banchina gli zinchi della prima barca formano una cella galvanica con tutti i metalli della seconda, che sono contemporaneamente collegati alla terra di banchina e immersi in mare. Gli zinchi della prima barca si consumeranno molto velocemente.
Per evitare questo problema, si installa nel filo di terra, che arriva dalla banchina, un isolatore galvanico che permette il passaggio delle correnti alternate e arresta quelle continue.
Taluni pensano che la corrente alternata sia incapace di causare corrosione basandosi sull’osservazione che invertendo in continuazione il proprio senso di percorrenza non sia in grado di produrre gli ossidi all’anodo. Ma non è così. Gli esperimenti hanno dimostrato che corrode, anche se per essere efficace necessita di correnti molto più elevate rispetto a quella continua. Ed ecco che gli impianti elettrici sui megayacht, sempre più grandi e complicati, diventano terreno fertile per le correnti vaganti.
Giulio Mazzolini
Ingegnere, vive e lavora tra Milano e Trieste. Per dieci anni è stato presidente dell’Accademia Adriatica Internazionale della Vela di Trieste, specializzata nei temi della sicurezza e della prevenzione degli infortuni in mare. È autore dei titoli Veleggio! e Prevenire le emergenze in mare, entrambi pubblicati da Magenes, e di Corrosione dei metalli nella barca, Cime a bordo, I nodi in barca e Le navi achee nel mare di Omero, editi da Il Frangente. Scrive regolarmente su «Bolina» articoli tecnici di nautica e tiene conferenze su corrosione e sicurezza in mare. Naviga su Imagine, una DIX 38’ in alluminio disegnata da Dudley Dix.
La corrosione dei metalli nella barca. Tutte le tecniche per evitarla
Libro https://www.frangente.com/libri/4100-art-Corrosione_dei_metalli_nella_barca.htm
eBook https://www.frangente.com/digitale/5121-art-Corrosione_dei_metalli_nella_barca.htm

EDITORE Edizioni il Frangente
ISBN 9788898023509
EDIZIONE 2015
PAGINE 96 ill. a colori
FORMATO 170 x 240 mm
RILEGATURA Brossura




